|
Vjera Lopac
Znanstveno nazivlje u fizici
3. Fizika i svakodnevni govor: toplina i temperatura
Razumijemo
li razliku između topline i temperature?
Toplina i temperatura
često se spominju u svakodnevnom govoru. Pri tome se ponekad i zamjenjuju jedna
s drugom, ili pak imaju nejasna značenja. U fizici su to dva bitno različita,
iako fundamentalno povezana pojma. Razlika je uočljiva već iz jedinica kojima
se mjere: toplina se mjeri džulima (J), a temperatura kelvinima (K) ili
Celzijevim stupnjevima ( oC), ovisno o temperaturnoj ljestvici kojom
se služimo.
Temperaturu nije
jednostavno definirati, čak i ako njezin smisao intuitivno dobro razumijemo. Definicija
koju najčešće nalazimo glasi: temperatura je veličina kojom se mjeri
odstupanje od toplinske ravnoteže. Što to znači? Dodirom možemo razlikovati
toplo i hladno: stavimo li ruku pod mlaz vode iz slavine, odmah ćemo prepoznati
je li voda hladna ili topla. No ako to učinimo nakon dugotrajnog boravka na
snijegu i grudanja, i hladna voda iz slavine učinit će nam se topla. Pri tome
zapravo ocjenjujemo razliku, odstupanje od nekog određenog stanja. Takvo se
stanje naziva toplinskom ravnotežom. Ako pri dodiru ruke i vode osjetimo da je
voda hladnija ili toplija od ruke, tada ruka i voda nisu u toplinskoj
ravnoteži. Prilagodimo li smjesu tople i hladne vode tako da voda bude mlaka,
dakle ni toplija ni hladnija od ruke, i da rukom ne osjećamo razliku, tada
možemo reći da su ruka i voda u toplinskoj ravnoteži, ili da imaju jednaku
temperaturu. U fizici se služimo točnijim nazivom i govorimo o termodinamičkoj
temperaturi. Termodinamička je temperatura skalarna fizikalna veličina,
jedna od sedam osnovnih veličina sustava SI i iskazuje se jedinicom kelvin (K).
Ona je uvijek pozitivna, pa se naziva još i apsolutna temperatura.
Toplina je, za razliku od temperature,
energija povezana s gibanjem čestica u tvari. Pojednostavljeno rečeno,
čestice se u tvari gibaju brže ako je temperatura viša, a sporije ako je
temperatura niža. No ne možemo svaku svaku energiju takvoga unutarnjega čestičnoga
gibanja nazvati toplinom. Pri dodiru dvaju tijela različitih temperatura, dio
energije gibanja prelazi s toplijega tijela na hladnije. Toplina je
upravo onaj dio unutarnje energije koji prelazi s jednog tijela na drugo
pri izjednačavanju njihovih temperatura, dakle pri uspostavljanju toplinske
ravnoteže.
Jedinica za mjerenje
topline istovjetna je s jedinicom za energiju: u SI sustavu to je džul (J). No zastarjele
jedinice, kalorija kao i kilokalorija, 1 kcal = 4187 J; katkad se još
uvijek spominju. Njihovo je podrijetlo u empirijskoj jednadžbi
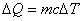
koja tvrdi da je količina topline koju treba dovesti nekoj tvari da bi se njezina temperatura povisila za
DT razmjerna masi tvari m
i povećanju temperature DT. Specifični je toplinski kapacitet c
konstanta karakteristična za pojedine tvari, a za vodu iznosi
c = 4187 J kg-1
K-1.
Mjerna je jedinica sustava
SI za termodinamičku temperaturu kelvin (K), a u uporabi su se zadržale i druge
temperaturne mjerne ljestvice, u prvom redu Celzijeva. Za nju se rabe znakovi t
ili q a jedinica je Celzijev stupanj
ºC. Zbog praktičnosti i velike proširenosti Celzijev je stupanj
( °C) zadržan kao dopuštena dopunska jedinica sustava SI.
U Celzijevoj temperaturnoj
mjernoj ljestvici nulta je točka određena ledištem vode (0 °C), dok je vrelište vode
na 100 °C. Celzijev stupanj ( °C) jednak je kelvinu (K),
a temperatura izražena u Celzijevim stupnjevima (znak t ili q ) povezana je s
termodinamičkom temperaturom T u kelvinima izrazom
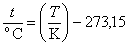 . .
Najniža vrijednost termodinamičke
temperature, T = 0 K ili t = -273,15 ºC, naziva se
i apsolutna nula. Ako se vrijednosti temperature iskazuju nekom drugom mjernom
ljestvicom, termodinamička je temperatura jednaka razlici zadane temperature i
temperature apsolutne nule.
Mikroskopsko
tumačenje topline i temperature
Vidjeli smo da se pravo mikroskopsko
značenje temperature i topline može razumjeti tek ako dublje proniknemo u
ponašanje čestica ‑ atoma i molekula ‑ od kojih se sastoji tvar, a
koje su uvijek u gibanju. U čvrstim tijelima čestice titraju oko svojih
ravnotežnih položaja, dok se u plinovima gibaju gotovo slobodno i pri tome
znatnim brzinama prelaze velike udaljenosti. Tu vezu možemo jednostavno iskazati
za jednoatomni idealni plin, u kojem čestice plina zamišljamo kao sićušne
kuglice koje se neovisno jedna od druge gibaju pravocrtnim stazama, a smjer
promijene samo pri sudaru sa stijenkom posude u kojoj se nalaze (Slika 1.)
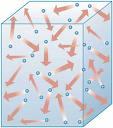
Slika
1.
Iako u svakom takvom plinu postoje
čestice s različitim brzinama, možemo pojednostavljeno zamisliti kao da se sve
čestice gibaju nekom prosječnom brzinom v. Zamislimo tako atom
helija, koji ima masu jednaku 4u (u = 1,66·10-27 kg
je atomska jedinica mase ili dalton), a giba se brzinom od 2500 metara u
sekundi, lako je izračunati da je njegova kinetička energija jednaka
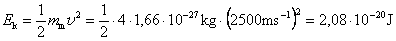 , ,
što, iskazano u
elektronvoltima, jedinicama uobičajenima u atomskoj fizici, iznosi Ek = 0,13 eV.
Ta je energija proporcionalna temperaturi: koliko se puta poveća prosječna
kinetička energija čestice, toliko će se puta povećati termodinamička
(apsolutna) temperatura. To nas vodi na jednadžbu proporcionalnosti, koja je
zapravo mikroskopska definicija temperature.
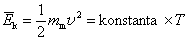 . .
Kad bi takav klasični plin
mogao postojati na temperaturi apsolutne nule, na toj bi se temperaturi čestice
prestale gibati. Vrijednost konstante povezana je s definicijom jedinice za
temperaturu, i u SI sustavu ona je jednaka (3/2)kB, gdje je kB = 1,38·10-23
J K-1 Boltzmannova konstanta, jedna od najvažnijih konstanti u prirodi.
Dakle, za jednoatomni
idealni plin termodinamička je temperatura definirana pomoću prosječne
kinetičke energije gibanja čestica izrazom
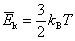 , ,
pa je
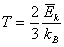 . .
Iz te relacije možemo
izračunati da se opisani plin helij nalazi na temperaturi 1010 K.
Broj čestica N možemo
izraziti pomoću količine tvari n iskazane jedinicom mol, omjerom N/NA= n,
gdje je NA = 6,022·1023 mol-1
Avogadrova konstanta. Ako u posudi ima N čestica, tada je ukupna
kinetička energija unutarnjeg gibanja svih čestica, koju još nazivamo i
unutarnja energija U, jednaka
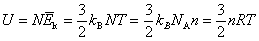 , ,
pri čemu je R poznata plinska konstanta
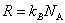 . .
Upravo je pojam unutarnje
energije bitan kako bismo razumjeli definiciju topline. Veza između temperature
i unutarnje energije složenija je za višeatomne plinove gdje, umjesto broja 3 u
konstanti proporcionalnosti, teorija daje 5 ili 7. Riječ je broju tzv.
stupnjeva slobode. Svaki stupanj slobode nosi količinu energije (1/2)kBT.
Atom helija mogli smo zamišljati kao malu kuglicu koja se giba u tri moguća
prostorna smjera: ona ima 3 stupnja slobode. No molekula dušika N2,
primjerice, izdužena je, pa može titrati ili se vrtjeti oko osi, što donosi
dodatne stupnjeve slobode. U čvrstim tvarima dodatni doprinosi dolaze i zbog
elastičnih sila među atomima tvari.
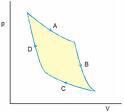
Postoji i druga definicija
termodinamičke temperature, koja se temelji na rezultatu za rad u Carnotovom
kružnom procesu (Slika 2).
Slika
2.
U jednom ciklusu Carnotova
kružnoga procesa, koji se sastoji od dvije adijabatske promjene (kod kojih nema
izmjene topline s okolinom) i dvije izotermne promjene (pri kojima se
temperatura ne mijenja), koristan se rad dobiva zahvaljujući izotermnim
dijelovima procesa, pa je omjer više temperature T1 i niže
temperature T2 jednak omjeru iznosa dovedene i odvedene
topline:
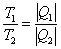
Ta je relacija temelj za
novu definiciju apsolutne temperature. Dvije su definicije u skladu jedna s
drugom, a iz obiju proizlazi da termodinamička temperatura ima pozitivnu
vrijednost, u skladu s drugim nazivom, pod kojim je poznata kao apsolutna
temperatura.
Standardi
za toplinu i temperaturu
Standardi za definicije i
mjerne jedinice topline i temperature opisani su u normi ISO 80000-5:2007 (Termodinamika). U izvornom obliku norma
je objavljena na engleskom i francuskom jeziku (Slika 3.)

Slika
3.
Prijevodi na druge jezike,
pa ni na hrvatski, zasad nisu službeno objavljeni. Ta je norma naslijedila
prijašnju normu ISO 31. U publikacijama iz fizike na hrvatskom jeziku obvezatno
se poštuju jedinice navedene u normi i njihove definicije. Međutim nazivi nisu
jednoznačno propisani, a definicije su često nepotpune, što je u uvodu čak i
naznačeno.
Tako je termodinamička
temperatura u normi ISO 80000-5 (Slika 4.) definirana kao "jedna od
osnovnih veličina Međunarodnog sustava veličina (ISQ) na kojima se temelji
Međunarodni sustav jednica (SI)", uz obrazloženje da je to veličina koja
se "mjeri s pomoću primarnih termometara, kakvi su plinski termometri sa
stalnim volumenom, akustični termometri i termometri s ukupnim zračenjem".
Mjerenje termodinamičke temperature temelji se na trojnoj točki vode: kelvin je
273,16-ti dio termodinamičke temperature trojne točke vode, za koju je propisan
izotopni sastav (Slika 5.)

Slika
4.

Slika
5.
Norma ISO 80000-5 navodi
pojmove kao što su Celzijeva i Fahrenheitova temperatura, kao da je riječ o
različitim fizikalnim veličinama, dok fizičari s pravom smatraju da je riječ o
jednoj fizikalnoj veličini, termodinamičkoj temperaturi, koja se iskazuje
različitim mjernim ljestvicama. U normi ISO 80000-5 kao dopuštena jedinica
naveden je i definiran Celzijev stupanj, međutim, uz očito pogrešan brojčani
podatak (Slika 6.).

Slika
6.
Ponegdje se još uvijek rabi Fahrenheitov stupanj (oF), jedinica koja nije sukladna s
Međunarodnim sustavom jedinica SI. U Fahrenheitovoj temperaturnoj mjernoj
ljestvici ledište je vode na 32 °F, a vrelište vode na 212 °F. Stupanj Fahrenheita (°F) jednak je (5/9)K.
Temperatura iskazana stupnjevima Fahrenheita preračunava se u stupnjeve Celzija
formulom
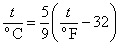 , ,
dok je veza s
termodinamičkom temperaturom (iskazanom jedinicom kelvin)
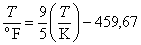 . .
Fahrenheitova temperaturna
ljestvica, iako zastarjela, u nekim je zemljama još uvijek u širokoj uporabi.
Na nju se opetovano nailazi, primjerice, u SAD-u, gdje se uporno provlači u
publikacijama i službenim dokumentima. Tamo se još rabi i temperaturna
ljestvica koja s pomoću Fahrenheitovih stupnjeva iskazuje apsolutnu temperaturu
i naziva se Rankine-ova temperaturna ljestvica. Fahrenheitova i Rankineova
mjerna ljestvica, kao i kalorija, navedene su u informativnim dodacima A i B na
kraju norme ISO 80000 ‑ 5:2007.
Dosad se pokazalo da se
tvorbom znanstvenog i strukovnog nazivlja za fizikalne pojmove kao i prevođenjem
na hrvatski jezik normi ključnih za fiziku najviše bave inženjeri tehnike i
jezikoslovci. Za dobrobit društva, a i radi autoriteta fizike kao struke, bilo
bi doista važno da dio svojega vremena tom poslu posvete i fizičari.
| 
