|
||||
|
Kristalna struktura leda Simetrija je prva činjenica koja upada u oči, bez obzira na raznolikost oblika snježnih pahuljica. Ona je i glavna komponenta njihove ljepote. I to šesterokutna, šesterokraka (heksagonska) simetrija. Već je Nakaya pokazao da, ako se rast odvija pri malim supersaturacijama, makroskopski oblik pahuljica uvijek je heksagonska prizma. Ovisno o temperaturi rasta (od 0oC do -40oC) prizma mijenja omjer bočne visine i promjera baze; prvo poprima oblike pločica, pa onda stupića pa opet pločica. S povećanjem supersaturacije
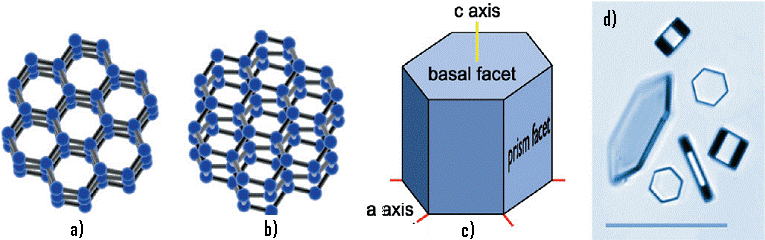
povećava se brzina rasta kristala, a s tim i dosegnuta veličina, a što je najupečatljivije, makroskopski im oblik postaje izrazito kompleksan, razgranat u nezamislivim varijacijama. Iako je krajnji oblik zamršen, heksagonska simetrija u cijelosti je sačuvana (vidi Sliku 08). Zametak heksagonske simetrije makroskopskih oblika leži u mikroskopskoj kistalnoj strukturi, to jest, u građi elementarne ćelije kristala leda. Strukturu kristala leda određuje međusobni prostorni odnos molekula vode. Struktura leda je pomoću rendgenskih zraka određena je još 1922. godine i nosi oznaku Ih (ili 6/m,m,m u Laueovoj klasifikaciji). Svaki kisikov atom u rešetki leda okružen je s 4 druga kisikova atoma u tetraedarskoj koordinaciji i udaljen 0.275 nm. Radi vizualizacije treba zamisliti kisikov atom u centru kocke i 4 druga u 8 vrhova tako da su razdvojeni plošnim dijagonalama. Između kisika u centru i onih na vrhovima nalazi se po jedan vodikov atom. Dva vodika su bliže smještena domicilnom kisikovom atomu na 0.098 nm skoro kao u slobodnoj molekuli vode. Molekula vode H2O u kristalnoj rešetki leda je stoga prepoznatljiva. Os simetrija 6 reda okomita je na baznu ravninu a zakret oko osi za 60o ponavlja jednaku konfiguraciju molekula. Najjednostavniji makroskopski oblik proporcionalan mikroskopskoj strukturi je prizma s dvije paralelne hekasgonske plohe i šest bočnih pravokutnih ploha (na Slici 07, c i d). Ono što nije odmah jasno jest kako se simetrija, ustanovljena energijski optimalnim prostornim odnosom kemijski povezanih molekula vode, dakle, s nanometarskih dimenzija, prenese na strukturu velikih snježnih kristala. Odgovor je jednostavan – facetiranjem*, a objašnjenje je kompleksno. Ono uključuje poznavanje fundamentalnih zakonitosti fizike površine u ravnoteži i izvan nje. Kao što je već spomenuto, način rasta površine kristala, izložene plinu molekula vodene pare i zraka, određuje specifični mikroskopski ustroj same površine, ali i difuzivnost molekula vodene pare u zraku. Slično objašnjenje vrijedi kad snježni kristal poprimi druge oblike kao što su pupanje, grananje ili pak dendritske oblike. Odgovor leži u detaljima uvjeta rasta koje ćemo u osnovnim crtama upoznati u nastavku ovog napisa. *(pojmovi : faceta i facetiranje bit će objašnjeni kasnije. Uvodno, facetiranje je proces u kojem kristal poprima oblik poliedra inače karakterističnog za oblike na niskim temperaturama. Poliedar je oblik je za koji je slobodna energija minimalna na T = 0 K, a specifičnost je i odraz simetrije svakog kristala) |
Sadržaj |
|||
|
piše dr. sc. Zlatko Vučić Institut za fiziku, Zagreb |
||||