 |
||
|
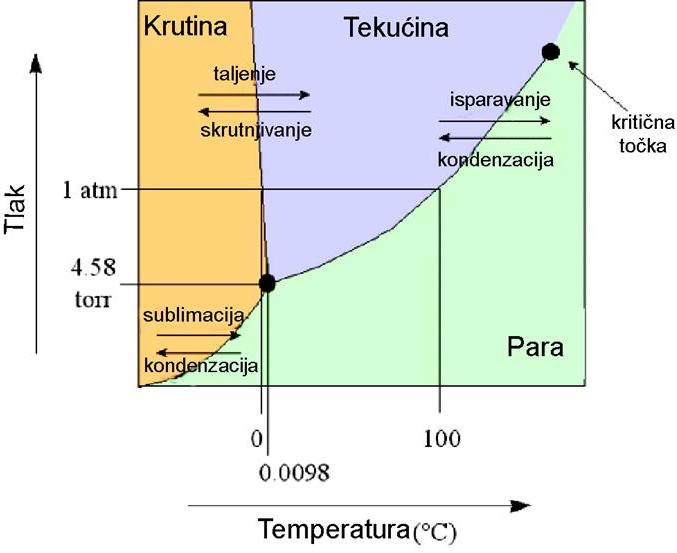
Fazni dijagram vode Proces nastajanja pahuljica u načelu je fizikalno razumljiv u okviru termodinamike jednostavnim tumačenjem faznog dijagrama vode. U zraku, na nekoj udaljenosti od površine Zemlje (istoznačno tlaku zraka), u ograničenom prostoru oblaka, unutar određenog opsega temperatura i vlažnosti, koegzistiraju (istodobno postoje) dva, a često i tri, agregatna stanja vode. Koegzistencija tekuće faze (kapljice vode kao suspenzija u zraku) i parovite faze (plin molekula vodene pare) je shvatljiva čim se pogleda ravnotežni fazni dijagram vode (Slika 02). Naime, bez obzira na temperaturu, no iznad trojne točke vode od 0.01oC, i bez obzira na tlak zraka, ravnotežni odnos tekuće i parovite faze vode određen je linijom koegzistencije u faznom dijagramu. To je linija koja razdvaja tekuću i parovitu fazu (Clausius-Clapeyronova (CC) relacija) odnosno ona predstavlja fizikalne uvjete u kojima je molekulama vode energijski svejedno hoće li biti u tekućoj ili parovitoj fazi. Drugim riječima, tlak vodene pare jednoznačno je određen temperaturom vode odnosno vodenih kapljica. To je ujedno i tlak zasićene vodene pare. Snizi li se temperatura ispod 0oC tekuća faza bi se trebala skrutnuti u led i opet bi promatrani sustav bio u skladu s faznim dijagramom, to jest postojale bi samo dvije faze, led i para. No to se rijetko događa. Puno češće kapljice vode ostaju u tekućem stanju, premda pothlađene. Pothlađene vodene kapljice, na površini kojih nema kemijskih i mehaničkih nečistoća, mogu održati tekuće stanje sve do -41oC, nakon koje temperature obvezno kristaliziraju u led. U stvarnosti, upravo zbog nečistoća na površini, one se počinju smrzavati i na višim temperaturama od -41oC. Nečistoće na površini imaju jednaku ulogu kao i zrnca prašine kod inicijalne kristalizacije pahuljice – djeluju kao centri oko kojih počinje kristalizacija.
Stoga se smatra, a i eksperimentalno je pokazano [2], da u sustavu oblaka dovoljno dugo vrijede relativno stabilni uvjeti. Nema brzih promjena ni temperature niti vlažnosti. Nema ni drugih neravnotežnih procesa koji inače mogu izazvati, i izazivaju, promjene stanja, kao što su jaka strujanja zraka unutar oblaka, osunčavanja gornje površine oblaka, usisavanja svježe vlage izvana i slično. Oblak se smatra stabilnim izoliranim termodinamičkim sustavom. Unutrašnjost oblaka teži stanju ravnoteže na način da se, ako je temperatura viša od 0oC, brzo uravnotežuje odnos količine vodenih kapljica i vodene pare. Parcijalni tlak vodene pare postaje saturacijski (zasićeni)i toj vlažnosti pripisujemo relativnu vlažnost od 100%. To je ujedno i zasićena vodena para. Ako se tlak vodene pare malo poveća (iznad 100%) počinje kondenzacija vodene pare natrag u vodu sve dok tlak opet ne postane saturacijski. Obrnuto, ako se tlak zbog nekog razloga snizi počinje isparavanje prisutnih kapljica da bi se sustav vratio u ravnotežu. U ravnoteži sustav ima minimalnu slobodnu energiju i na svaku pobudu sustav spontano reagira silama-energijskim gradijentima koji ga vraćaju u ravnotežu. Budući da saturacijski tlak para ovisi o veličini kapljica (za male kapljice) to se također izjednačuju kapljice po veličini (male kapljice isčezavaju na račun većih). Riječ ravnoteža u slučaju tri faze ne treba shvaćati doslovno jer su kapljice pothlađene vode stalno u neravnoteži (metastabilna ravnoteža). Uostalom i sam proces rasta je u pravilu neravnotežan. Na temperaturama nižim od 0oC koegzistiraju sve tri faze: tekuća (pothlađena), parovita i kruta (kristalići leda – snježne pahuljice). Njihov količinski odnos ovisi o visini, odnosno temperaturi i tlaku zraka te o vlažnosti. Za pojavu i rast krute faze ili kristalića leda, uz uvjet inicijalne nukleacije, odgovorna je povećana vlažnost iznad zasićene, a nazivamo je prezasićenost ili supersaturacija Saturacija (zasićenost) i supersaturacija (prezasićenost) Saturacijski tlak vodene pare iznad vode je tlak zasićene vodene pare koja je u termodinamičkoj ravnoteži s tekućom fazom, u stvari, suspenzijom kapljica vode u zraku. Formalno je opisan CC relacijom. Svako povećanje/smanjenje tlaka vodene pare vodi na kondenzaciju/isparavanje. To su procesi koji čuvaju termodinamičku ravnotežu sustava. Kondenzacija je povezana s prijenosom molekula iz pare u vodu, točnije na površinu vode. Dakle, da bi se ostvaro prijenos tvari iz parovite faze u kondenziranu (čvrstu ili tekuću) mora se povećati tlak ili koncentracija vodene pare iznad saturacijskih vrijednosti. Veličinu koja mjeri relativno odstupanje koncentracije ili (parcijalnog) tlaka vodene pare nazvat ćemo supersaturacijom ili prezasićenjem. Ona je, dakle, svako odstupanje tlaka ili koncentracije vodene pare od saturacijskog. Da bi bila veličina bez dimenzije nužno ju je normirati na saturacijski tlak. Ona je pokretačka sila za izmjenu tvari među fazama u oba smjera. Pojava supersaturacije je znak neravnoteže. Formalno se supersaturacija piše kao
gdje su ppovr i cpovr stvarni, trenutni tlak i koncentracija vodene pare, dok su psat i csat saturacijski tlak i koncentracija, svi tik uz površinu kapljice. Sve navedene veličine su ovisne o temperaturi. U slučaju zasićene vlage odnosno saturacije σ = 0, a relativna vlažnost 100%. U stvarnosti u oblacima supersaturcija se može popeti do iznosa 1, odnosno relativna vlažnost do 200%. Kako u oblaku dolazi do uspostave supersaturacije veće od 0? Stvarnost je sljedeća. Snizi li se temperatura oblaka snižava se parcijalni tlak vodene pare.
Istodobno ohlade se i kapljice vode. Kad će kapljice i koliko brzo kristalizirati ovisi o nečistoćama na njihovoj površini, o njihovoj veličini kao i o brzini snižavanja temperature. Pothlađene kapljice, bez obzira na 'pothlađenost', imaju 'ravnotežni' saturacijski tlak para koji naravno ovisi o temperaturi i opada sa sniženjem temperature, kao da se radi o običnoj vodi na temepraturama ispod 0oC. (Slika 03) 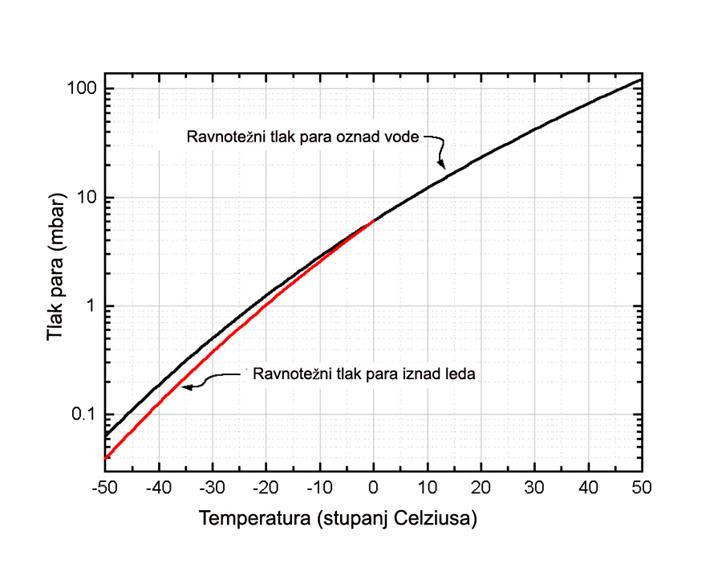 Slika 03: Saturacijski tlak vodene pare u ovisnosti o temperaturi
Slika 03: Saturacijski tlak vodene pare u ovisnosti o temperaturi
Saturacijski tlak pothlađene vode je, međutim, uvijek nešto veći nego što je saturacijski tlak para leda na istoj temperaturi. Tako pothlađene i mnogobrojne kapljice vode predstavljaju termodinamički spremnik materijala za događaj koji slijedi. To je proces formiranja sićušnih ledenih kristalića, nukleusa snježnih pahuljica, veličine nekoliko stotina molekula, na zrncima prašine. Stvaranje nukleusa, dakle hvatanje molekula vodene pare za površinu submikronskih zrnaca prašine, kao i daljnji rast (molekula po molekula) posljedica je uspostavljene stabilne supersaturacije. Naime, tlak para kristalića leda niži je od onog pothlađene vode na istoj temperaturi pa molekule vodene pare, ako nema neke prepreke – barijere, uvijek 'izabiru', to jest, tjerane su u niže energijsko stanje, a to je led (vidi Sliku 04). Na danoj temperaturi proces se zaustavlja kad nestanu, potroše se, kapljice vode.
Treba uočiti da je na Slici 03 apscisa (os temperature) orijentirana na uobičajen način tako da vrijednosti rastu u desno. Na Slici 04, pak, vrijednosti na osi temperature padaju u desno. Kako je taj naopaki način prikaza temperaturne skale za fiziku snježnih pahuljica uobičajen, on će i nadalje biti sustavno korišten. Daljnji tijek rasta, a to znači brzina rasta i oblici
koje će kristal poprimiti tijekom rasta u oblaku, prije nego što, zbog
težine, započne pad prema tlu, ovisit će o dvama čimbenicima: Svaki od navedenih bit će posebno raspravljen. Prije toga pogledajmo tko je sve u prošlosti značajno pridonio znanju o snježnim pahuljicama. |
Sadržaj |
|
|
piše dr. sc. Zlatko Vučić Institut za fiziku, Zagreb |
||
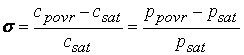
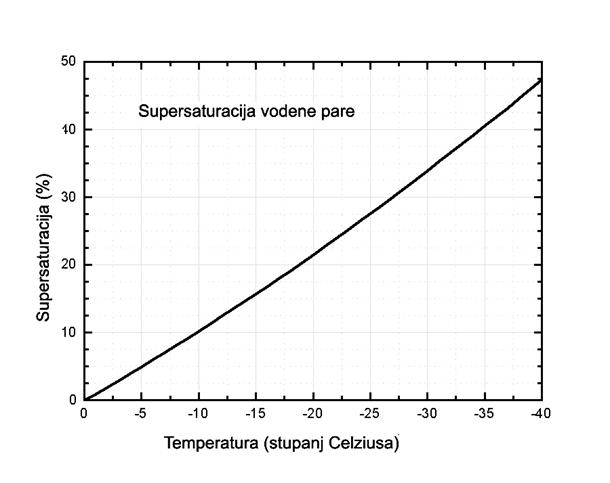 Slika 04: Ovisnost supersaturacije o temperaturi
Slika 04: Ovisnost supersaturacije o temperaturi